Terapia Car-T Cell: Anvisa autoriza estudo com tratamento revolucionário contra o câncer
A Anvisa autorizou a Fundação Hemocentro de Ribeirão Preto (FUNDHERP), em parceria com o Instituto Butantan, a realizar o ensaio clínico no Brasil com o CAR-T Cell, a técnica que combate o câncer no sangue com as próprias células de defesa do paciente modificadas em laboratório. Oitenta e um pacientes passarão pelo estudo.
Segundo a Anvisa, os estudos estão em fase clínica inicial. O objetivo é avaliar a segurança e a eficácia no tratamento de pacientes com leucemia linfoide aguda B e linfoma não Hodgkin B, recidivados e refratários, em casos de reaparecimento da doença ou de resistência ao tratamento padrão.
Segundo Dimas Covas, à frente do estudo, nenhum paciente foi escolhido até agora. “O estudo agora vai definir a seleção dos pacientes. Inicialmente em Ribeirão Preto, depois São Paulo e Campinas”. Os pacientes precisam entrar em contato pelo e-mail: [email protected]
“A aprovação desse ensaio clínico é parte de um projeto inovador de colaboração regulatória entre a Anvisa e pesquisadores e desenvolvedores brasileiros. O objetivo é impulsionar o desenvolvimento de produtos de terapias avançadas disponíveis no Sistema Único de Saúde (SUS)”, escreveu a agência.
A Anvisa e os patrocinadores fizeram reuniões periódicas e discussões de dados e elaboração de documentos técnicos e regulatórios, que foram submetidos continuamente “com inteira dedicação e prioridade por parte da equipe técnica da Agência”, afirmou.
Foram 104 dias de avaliação documental realizada pela agência e 144 dias de respostas às exigências trabalhadas pela FUNDHERP.
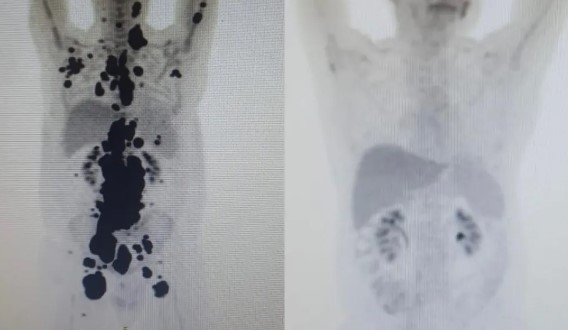
Pacientes, como Paulo Peregrino, que teve remissão total do câncer, passaram pelo tratamento de forma “compassiva”, ou seja, por meio de uma autorização da Anvisa, de forma individualizada, para pessoas que já tinham esgotados todos os tratamentos aprovados possíveis.
Como será o estudo?
- Após a aprovação do início do ensaio clínico, a Anvisa criou um plano de acompanhamento.
- Isso envolve revisões frequentes dos dados e informações da pesquisa, com ações planejadas até dezembro de 2024, para monitorar de perto o desenvolvimento do produto.
- Se os resultados forem bons, o objetivo é registrar o produto rapidamente para que as pessoas tenham acesso a uma opção de tratamento segura, eficaz e de alta qualidade disponível no SUS.
- 81 pacientes serão tratados com o produto e serão monitorados no estudos.
- A técnica é utilizada em poucos países. No Brasil, no segundo semestre, os pacientes serão tratados com o CAR-T Cell com verba pública após autorização da Anvisa para o estudo clínico.
- Atualmente, o terapia só existe na rede privada brasileira, ao custo de ao menos R$ 2 milhões por pessoa.
reportagem completa no g1
Escreva sua opinião
O seu endereço de e-mail não será publicado.